-
新闻
应用文献丨在CEL-G® Culture Ad60系列固定床生物反应器中连续高效生产外泌体的工艺研究
发布日期:2024-08-26
外泌体(exosome)是一类直径为 30-150 nm,具有完整膜结构的细胞外囊泡,主要负责细胞间的物质运输和信息传递,因此可以用作无细胞治疗药物。在各种细胞来源的外泌体中,间充质干细胞外泌体(MSCs-Exo)在免疫调节和再生修复领域的研究中显示出了良好的抗炎、抗衰老及促伤口愈合作用。在本研究中,为了稳定培养脐带来源的间充质干细胞(Umbilical Cord Mesenchymal Stem Cells,UC-MSCs)并进行多批次收获高浓度外泌体,我们使用 CEL-G® Culture Ad60 系列固定床生物反应器(CEL-G® Culture Ad60 Fixed Bed Reactor,Ad60 FBR)进行 UC-MSCs 的 3D 培养。以含有 5% 营养添加物的 MSC Basal SFM 细胞培养基在 2D 条件下进行扩增传代,按照 2×104 cells/cm2 的细胞密度接种至固定床生物反应器中进行 3D 培养。使用含有 5% 营养添加物的 MSC ExoPro SFM 细胞培养基促使 UC-MSCs 高表达外泌体(UC-MSCs-Exo)并进行多批次收获。通过生化指标及 UC-MSCs-Exo 的颗粒浓度结果显示 UC-MSCs 能够在 Ad60 FBR中稳定生长并高产外泌体,总计收获 7 批次细胞上清液,外泌体累计产量达 1.12×1015 particles。我们的研究揭示了 Ad60 FBR能够稳定培养 UC-MSCs 并进行多批次 UC-MSCs-Exo 收获的应用潜力。
外泌体(exosome)是由细胞内多囊泡体(multivesicular body,MVB)与细胞膜融合后,以出芽形式释放到细胞外基质中的双层膜囊泡小体。其直径通常在 30-150 nm 之间,内部包裹有蛋白、脂类、mRNA 和 micro RNA 等多种成分[1-3]。外泌体天然存在于体液中,可通过自分泌或旁分泌途径被细胞吸收[3-5],也可经循环系统运送被远距离靶组织或器官所吸收,从而参与机体多种生理和病理过程。目前,外泌体作为细胞间通讯及循环的生物标志物,还展现出基因和药物递送载体的潜力。
研究表明外泌体与免疫反应、病毒致病性[6-7]、心血管疾病、中枢神经系统相关疾病和癌症进展有关[8]。外泌体递送到靶向细胞后能有效地改变其生物学特性,这种诱导反应对疾病的发展有着促进或抑制作用。外泌体由于其低免疫原性、低毒性且能够跨越血脑屏障等优势可作为药物或药物递送载体的潜力正在被探索中[8]。此外,外泌体还具有疾病诊断的潜力[9-10],微环境和细胞固有的生物学特性可能影响外泌体的含量及其生物学标志物,因此可通过生物体液的采样及外泌体组分分析来确定病症及预后情况[11-13]。
作为一种新的研究热点,外泌体由于其广泛分布和可用性已经成为诊断和治疗潜在疾病的有效方法。它们为临床应用开辟了广阔的前景,如医疗美容,疾病诊断,疫苗开发,免疫疗法,细胞和基因疗法。然而,外泌体的检测方法主要集中在测量颗粒的大小和数量以及检测表面蛋白质和含量,这些检测方法大多都在细胞水平上进行分析。虽然也经小鼠模型开展生理实验进行实际功能确认,但是小鼠层面观察到调节癌症进展,组织再生等生理学现象与细胞培养衍生的外泌体作用[14-19]是否是相关的还有待考证。其次,在生产过程中,外泌体是由细胞产生的,起着代谢物的作用。它们的功能特征取决于细胞特征和生产过程。细胞密度、培养条件和收获频率等条件的变化可能导致细胞外泌体的功能异质性。并且从过程安全的角度来看,最好使用封闭系统,但这比开放系统更难控制。此外,作为新型生物制品,没有专门针对外泌体质量控制的法规和指导原则。目前,主要方法是参考细胞治疗指南和国内外相关团体标准。虽然外泌体是细胞产物,但外泌体制造过程的稳定性比细胞要低,其质量控制需要在参照生物制品质量管理规范的基础上进一步提高针对性。
来源于干细胞的外泌体在多个方面具有巨大的治疗潜力[20]。据报道,在干细胞分泌组的一部分中,外泌体在旁分泌作用中发挥主要作用[21-23]。根据过去十年的大量临床数据表明,间充质干细胞(Mesenchymal Stem Cells,MSCs)本身就是安全的[20],这使得 MSCs 成为治疗性外泌体的最优选来源。此外,MSCs 衍生的外泌体可以通过过滤除菌并作为现成产品生产,用于各种疾病模型中的新的无细胞治疗策略,包括神经、心血管、免疫、肾脏、肌肉骨骼、肝脏、呼吸系统、眼睛和皮肤疾病,以及癌症[20, 22, 24-26]。
通常在 MSCs 的治疗用途中,由于注射所需的细胞数量远远超过可从组织本身分离的细胞数量,因此在注射前需要在体外对这些细胞进行扩增和分化[27]。目前 MSCs 的体外培养主要依赖于细胞瓶或细胞工厂进行贴壁生产,该工艺过程相对成熟,但作为传统二维(2D)培养具有人工成本高、批次生产数量有限、无法实时监测细胞增殖状态和质量情况。因此,使用生物反应器等三维(3D)培养方式进行 MSCs 的扩大培养逐渐成为研究热点。研究表明,哺乳动物细胞的体外 2D 和 3D 培养需要合适的细胞培养基和血清富集[28]。最佳的培养、增殖和分化方案在治疗结果中起着关键作用。因此,确定 MSCs 培养的最佳培养方案和方法至关重要。影响研究结果的变量包括培养基、细胞密度、物理和化学环境,如可溶性 O2 和 CO2 浓度、pH 和温度[29]。事实上,在 3D 培养中,更能够模拟细胞真实的生长环境[30]。当 MSCs 在 3D 细胞培养中呈球状培养时,IL-11 等旁分泌因子[31]和促血管生成细胞因子碱性成纤维细胞生长因子(bFGF)的分泌增加[32]。此外,与在 2D 细胞培养中分泌的外泌体相比,当这些细胞以球状形式培养时,外泌体的产生显著增加[32-33](Figure 1)。而此时球体的中心区域缺乏氧气和营养。也正是因为球体内部区域的细胞团积累引起的轻度缺氧[34-35],从而增加了 MSCs 的存活率和这些细胞的分泌能力,同时也增加了 MSCs的血管生成潜力,影响球形 MSCs 治疗效果。A. Hazrati 等人在 3D 细胞培养中,通过诱导 3D 细胞培养中产生 CXCL12、HGF、VEGF、FGF-2 和血管生成素(ANG)、血管生成素 2(ANGPT-2)和 HIF-1α 等分子[36-37]。同时,也有研究数据表明在 3D 培养条件下产生的 MSC-Exo 通过刺激 HMGB1-AKT 信号通路能够促进血管生成,同时在肾脏、骨软骨、炎症性肠病和内皮细胞血管生成方面的作用比 2D 培养条件下产生的 MSC-Exo 更有效[38](Figure 2)。
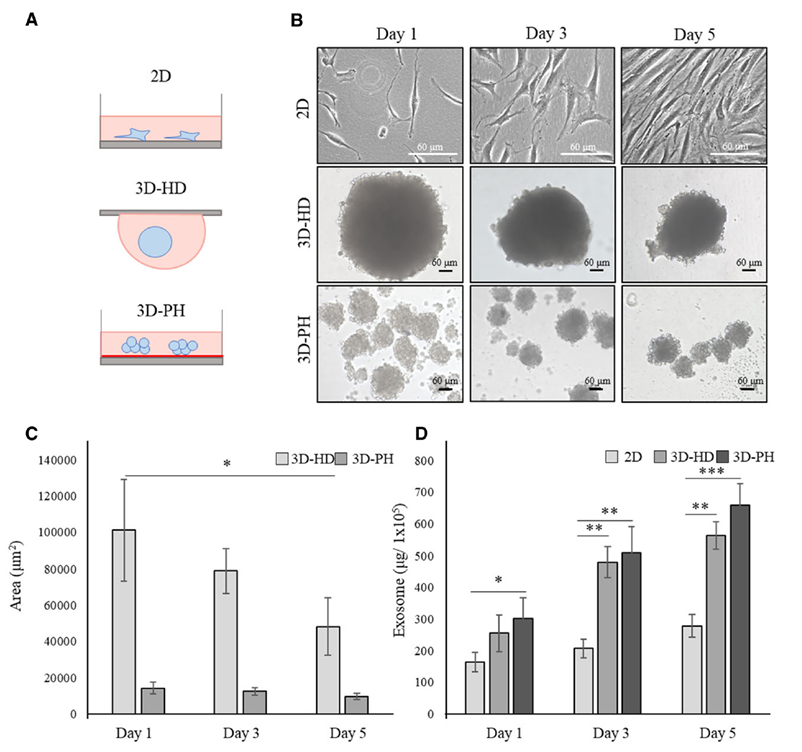
Figure 1. MSCs 在 2D 和 3D 培养条件下培养不同天数对比。(A)示意图; (B)显微形态; (C)球体大小; (D)外泌体生产效率。
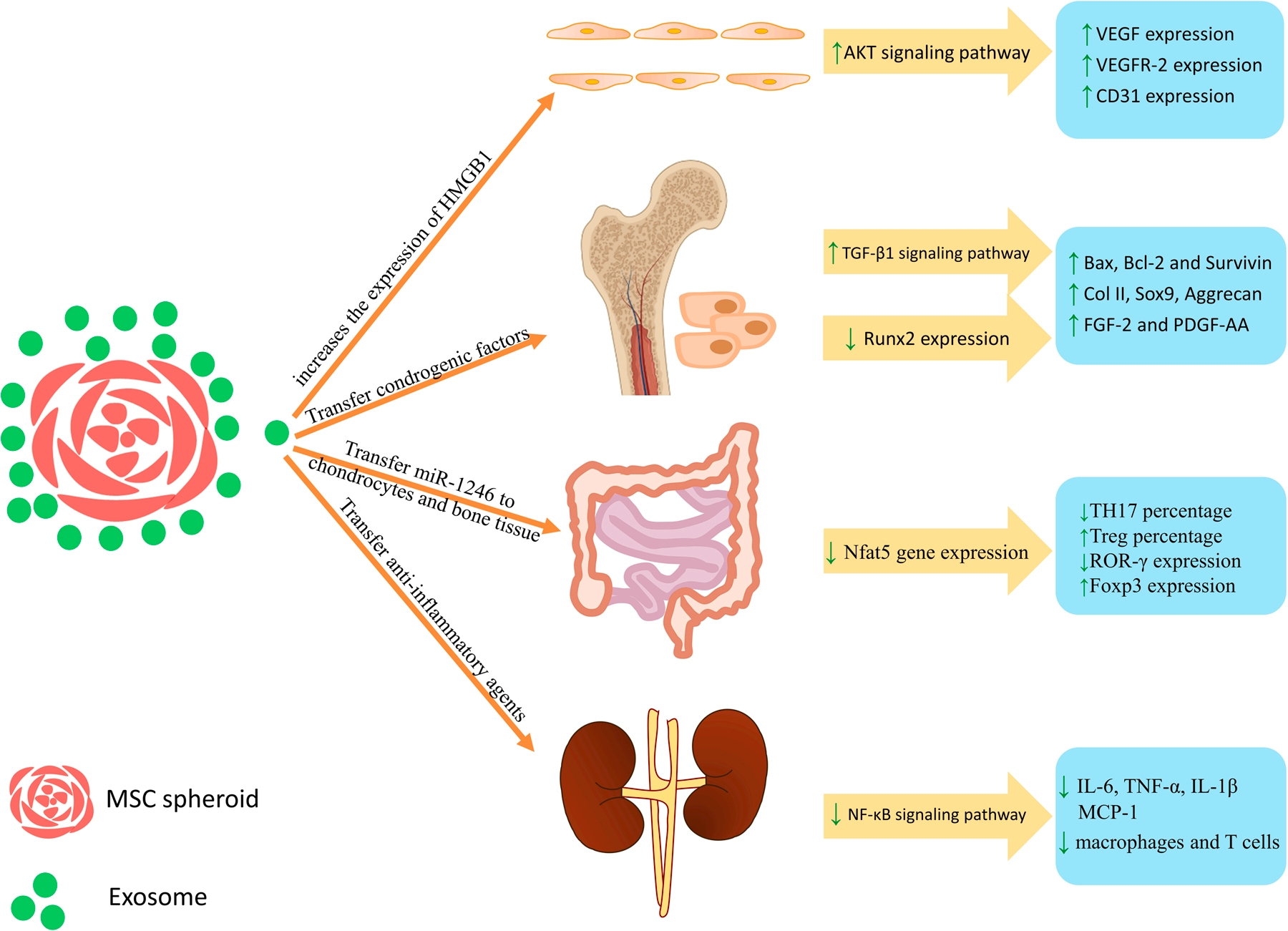
Figure 2. UC-MSCs-Exo参与的信号通路调节及下游调控因子上调下调情况。
CEL-G® Culture Ad60 系列固定床生物反应器(Ad60 FBR)由同腾(新创)生物科技有限公司自主研发,反应器由一个不锈钢罐体培养容器与控制主机构成,培养罐体内采用双层医药级别 PET 膜材支架提供细胞生长 3D 微环境,具有独特的瀑布流设计,让固定床具备更小的剪切力,提供更加亲和的细胞培养环境,控制主机体型较小可以放入生物安全柜进行无菌操作。Ad60 FBR 优势在于对培养过程中培养参数有着精准控制,同时能够通过取样条监测细胞生长密度,以此可以检测并评估培养过程中细胞生长状态,并对 UC-MSCs-Exo 收获时间提供指导。此外,UC-MSCs 在 Ad60 FBR 中培养时呈现 3D 球状,这也更有利于 UC-MSCs 分泌 UC-MSCs-Exo。
本研究的目的是为了开发稳定连续培养 UC-MSCs 生产UC-MSCs-Exo的工艺,我们使用 Ad60 FBR 进行 UC-MSCs 3D 培养,促使 UC-MSCs 高效分泌 UC-MSCs-Exo 并进行多批次 UC-MSCs-Exo 收获。

Figure 3. CEL-G® Culture Ad60 系列生物反应器整体示意图。
在本研究中,我们成功培养并稳定传代了 UC-MSCs。将UC-MSCs按照 2×104 cells/cm2 的密度接种至 Ad60 FBR 2 m2的固定床上进行 15 天的培养并收获了 7 批次细胞上清液。和 2D 培养时呈纤维状细胞样不同, UC-MSCs 细胞在Ad60 FBR 中能够自发形成多细胞球体并高效分泌 UC-MSCs-Exo。我们的研究揭示了 Ad60 FBR 能够连续稳定培养 UC-MSCs 细胞并进行多批次 UC-MSCs-Exo 收获的应用潜力。
除了生产UC-MSCs-Exo外,Ad60 FBR 在多个领域均有应用,如病毒载体、疫苗生产及溶瘤病毒生产等。由现有贴壁细胞培养过程中所获得的丰富产品及易于转移的生产流程,均展示了Ad60 FBR 的多功能性及其巨大的应用潜力。
总体而言,Ad60 FBR 是传统“规模放大”技术的合适替代方案,并且能够比现有的贴壁细胞培养技术如培养皿、细胞工厂等具有更高的产量及性价比。目前的Ad60 FBR已涵盖从 1 m2至60 m2 的细胞生长面积,可实现低成本、大规模、高产量的生产能力,将为疾病治疗、药物递送、皮肤再生美学等领域提供广泛的应用与支持。
[1] R. Kalluri, The biology and function of exosomes in cancer. J. Clin. Invest. 126, 1208–1215 (2016).
[2] M. P. Bebelman, M. J. Smit, D. M. Pegtel, S. R. Baglio, Biogenesis and function of extracellular vesicles in cancer. Pharmacol. Ther. 188, 1–11 (2018).
[3] M. Mathieu, L. Martin-Jaular, G. Lavieu, C. Théry, Specificitiesof secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat. Cell Biol. 21,9–17 (2019).
[4] L. A. Mulcahy, R. C. Pink, D. R. Carter, Routes and mechanisms of extracellular vesicle uptake. J. Extracell. Vesicles 3, 24641 (2014).
[5] K. J. McKelvey, K. L. Powell, A. W. Ashton, J. M. Morris, S. A. McCracken, Exosomes: Mechanisms of uptake. J Circ Biomark 4, 7 (2015).
[6] J. Wang et al., Host derived exosomes-pathogens interactions: Potential functions of exosomes in pathogen infection. Biomed. Pharmacother. 108, 1451–1459 (2018).
[7] A. Marcilla et al., Extracellular vesicles in parasitic diseases.J. Extracell. Vesicles 3, 25040 (2014).
[8] M. Tkach, C. Théry, Communication by extracellular vesicles:Where we are and where we need to go. Cell 164, 1226–1232(2016).
[9] L. Vojtech et al., Exosomes in human semen carry a distinctive repertoire of small non-coding RNAs with potential regulatory functions. Nucleic Acids Res. 42, 7290–7304 (2014).
[10] R. Menon et al., Circulating exosomal miRNA profile during term and preterm birth pregnancies: A longitudinal study. Endocrinology 160, 249–275 (2019).
[11] R. Menon et al., Quantitative proteomics by SWATH-MS of maternal plasma exosomes determine pathways associated with term and preterm birth. Endocrinology 160, 639–650 (2019).
[12] S. Sheller-Miller, J. Trivedi, S. M. Yellon, R. Menon, Exosomes cause preterm birth in mice: Evidence for paracrine signaling in pregnancy. Sci. Rep. 9, 608 (2019).
[13] B. P. Foster et al., Extracellular vesicles in blood, milk and body fluids of the female and male urogenital tract and with special regard to reproduction. Crit. Rev. Clin. Lab. Sci. 53, 379–395 (2016).
[14] S. Kamerkar et al., Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature 546, 498–503 (2017).
[15] P. Gangadaran, C. M. Hong, B. C. Ahn, An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Front. Pharmacol. 9, 169 (2018).
[16] P. Gangadaran et al., A new bioluminescent reporter system to study the biodistribution of systematically injected tumor-derived bioluminescent extracellular vesicles in mice. Oncotarget 8, 109894–109914 (2017).
[17] C. P. Lai et al., Dynamic biodistribution of extracellular vesicles in vivo using a multimodal imaging reporter. ACS Nano 8, 483–494 (2014).
[18] M. Morishita, Y. Takahashi, M. Nishikawa, Y. Takakura, Pharmacokinetics of exosomes: An important factor for elucidating the biological roles of exosomes and for the development of exosome-based therapeutics. J. Pharm. Sci. 106, 2265–2269 (2017).
[19] M. Mendt et al., Generation and testing of clinical-grade exosomes for pancreatic cancer. JCI Insight 3, e99263 (2018).
[20] Han, C.; Sun, X.; Liu, L.; Jiang, H.; Shen, Y.; Xu, X.; Li, J.; Zhang, G.; Huang, J.; Lin, Z.; et al. Exosomes and their therapeutic potentials of stem cells. Stem Cells Int. 2016, 2016, 7653489. [21] Liang, X.; Ding, Y.; Zhang, Y.; Tse, H.F.; Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: Current status and perspective. Cell Transplant. 2014, 23, 1045–1059.
[22] Phinney, D.G.; Pittenger, M.F. Concise review: MSC-derived exosomes for cell-free therapy. Stem Cells 2017, 35, 851–858.
[23] Lai, R.C.; Arslan, F.; Lee, M.M.; Sze, N.S.K.; Choo, A.; Chen, T.S.; Salto-Tellez, M.; Timmers, L.; Lee, C.N.; Oakley, R.M.E.; et al. Exosome secreted byMSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010, 4, 214–222.
[24] Lou, G.; Chen, Z.; Zheng, M.; Liu, Y. Mesenchymal stem cell-derived exosomes as a new therapeutic strategy for liver diseases. Exp. Mol. Med. 2017, 49, e346.
[25] Nooshabadi, V.T.; Mardpour, S.; Yousefi-Ahmadipour, A.; Allahverdi, A.; Izadpanah, M.; Daneshimehr, F.; Ai, J.; Banafshe, H.R.; Ebrahimi-Barough, S. The extracellular vesicles-derived from mesenchymal stromal cells: A new therapeutic option in regenerative medicine. J. Cell. Biochem. 2018, 119, 8048–8073.
[26] Mendt, M.; Rezvani, K.; Shpall, E. Mesenchymal stem cell-derived exosomes for clinical use. Bone Marrow Transplant. 2019, 54, 789–792.
[27] M. Kirsch, J. Rach, W. Handke, A. Seltsam, I. Pepelanova, S. Strauß, P. Vogt, T. Scheper, A. Lavrentieva, Comparative analysis of mesenchymal stem cell cultivation in fetal calf serum, human serum, and platelet lysate in 2D and 3D systems, Front. Bioeng. Biotechnol. 8 (2021) 1499.
[28] H.T.H. Bui, L.T. Nguyen, U.T.T. Than, Influences of xeno-free media on mesenchymal stem cell expansion for clinical application, Tissue Eng. Regen. Med. 18 (1) (2021) 15–23.
[29] D. Mushahary, A. Spittler, C. Kasper, V. Weber, V. Charwat, Isolation, cultivation, and characterization of human mesenchymal stem cells, Cytometry Part A 93 (1) (2018) 19–31.
[30] K. Duval, H. Grover, L.H. Han, Y. Mou, A.F. Pegoraro, J. Fredberg, Z. Chen, Modeling physiological events in 2D vs. 3D cell culture, Physiology 32 (4) (2017) 266–277.
[31] T.J. Bartosh, J.H. Ylostalo, ¨ A. Mohammadipoor, N. Bazhanov, K. Coble, K. Claypool, R.H. Lee, H. Choi, D.J. Prockop, Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties, Proc. Natl. Acad. Sci. USA 107 (31) (2010) 13724–13729.
[32] M. Kim, H.W. Yun, D.Y. Park, B.H. Choi, B.H. Min, Three-dimensional spheroid culture increases exosome secretion from mesenchymal stem cells, Tissue Eng. Regen. Med. 15 (4) (2018) 427–436.
[33] S. Thippabhotla, C. Zhong, M. He, 3D cell culture stimulates the secretion of in vivo like extracellular vesicles, Sci. Rep. 9 (1) (2019) 1–14.
[34] I.A. Potapova, G.R. Gaudette, P.R. Brink, R.B. Robinson, M.R. Rosen, I.S. Cohen, S.V. Doronin, Mesenchymal stem cells support migration, extracellular matrix invasion, proliferation, and survival of endothelial cells in vitro, Stem Cells 25 (7) (2007) 1761–1768.
[35] S. Sart, A.C. Tsai, Y. Li, T. Ma, Three-dimensional aggregates of mesenchymal stem cells: cellular mechanisms, biological properties, and applications, Tissue Eng. Part B Rev. 20 (5) (2014) 365–380.
[36] S.H. Bhang, S.W. Cho, W.G. La, T.J. Lee, H.S. Yang, A.Y. Sun, S.H. Baek, J. W. Rhie, B.S. Kim, Angiogenesis in ischemic tissue produced by spheroid grafting of human adipose-derived stromal cells, Biomaterials 32 (11) (2011) 2734–2747.
[37] H.-Y. Yeh, B.H. Liu, M. Sieber, S.H. Hsu, Substrate-dependent gene regulation of self-assembled human MSC spheroids on chitosan membranes, BMC Genom. 15 (1) (2014) 1–14.
[38] Hazrati Ali, Malekpour Kosar, Soudi Sara et al. Mesenchymal stromal/stem cells spheroid culture effect on the therapeutic efficacy of these cells and their exosomes: A new strategy to overcome cell therapy limitations.[J] .Biomed Pharmacother, 2022, 152: 113211.
[39] Ali H , Kosar M ,Sara S , et al. Mesenchymal stromal/stem cells spheroid culture effect on the therapeutic efficacy of these cells and their exosomes: A new strategy to overcome cell therapy limitations.[J].Biomedicine & pharmacotherapy,2022,152113211-113211.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
