-
新闻
CEL-G®TFF Lab系列外泌体浓缩系统高效提取牙髓干细胞外泌体的创新技术
发布日期:2024-11-15
近年来,牙髓干细胞(Dental Pulp Stem Cells,简称DPSC)作为再生医学领域的佼佼者,具有广泛的应用潜力。随着研究的不断深入,新的风口已经出现,它就是牙髓干细胞来源的外泌体(Dental Pulp Stem Cells Exosome,DPSC-EXO)。外泌体(Exosome)是细胞外囊泡(Extracel lular vesicles,EVs)的一种,为核内体来源,是由细胞通过“内吞-融合-释放”过程分泌的膜性囊泡样小体,直径为30-150 nm[1]。外泌体携带蛋白质、脂类、遗传物质如RNA等多种生物活性分子。外泌体可以通过将mRNA、microRNA、蛋白质和细胞器分泌因子等转移到受体细胞中来促进细胞间的通讯,因此被认为是组织再生和修复治疗的潜在药物[2]。
牙髓干细胞外泌体作为一种治疗工具,在口腔医学领域具有广泛的应用前景,特别是在牙周病和骨组织修复方面。随着研究的深入,牙髓干细胞外泌体在牙组织再生、神经再生、血管生成、骨再生、抗炎和免疫调节方面具有广泛的应用[3]。由于DPSC-EXO是治疗各种疾病的有效药物载体,因此,牙髓干细胞外泌体可以治疗牙周炎、神经炎症疾病、糖尿病神经病变、炎症性肠病、慢性阻塞性肺病、帕金森等疾病[4]。随着对牙髓干细胞外泌体需求的越来越大,足够量DPSC-EXO提取仍然是阻碍其治疗应用的障碍。
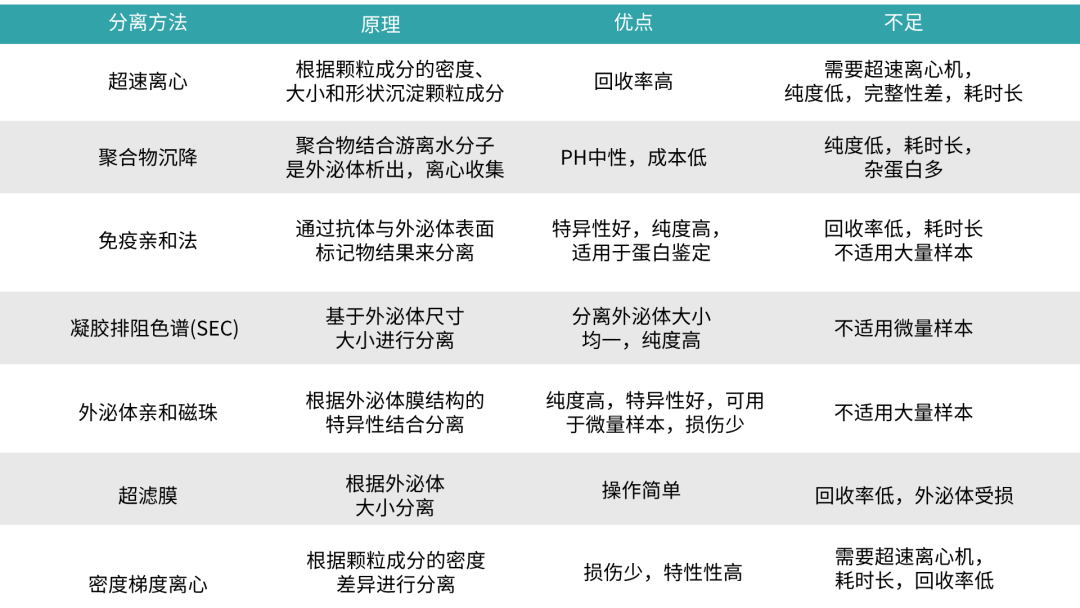
牙髓干细胞外泌体主要来源于牙髓干细胞上清。传统的DPSC-EXO提取方法主要包括超速离心法、聚合物沉淀法、免疫亲合法、凝胶排阻色谱法、亲和磁珠法、超滤膜法、密度梯度离心法等,存在耗时长、完整性差、不适合规模化处理等不足之处(表1)。
表1 传统的外泌体提取方法
相对比传统的DPSC-EXO提取方式,同腾新创自主研发的CEL-G®TFF Lab系列外泌体浓缩系统(图1),是一款基于三级分离原理实现外泌体浓缩收获的自动化处理设备。本系统配备控制器主机,人机交互界面和一次性封装耗材包,采用切向流高效过滤纯化技术,自动运行清洗-浓缩-收获-缓冲液置换等多级程序,实时监测、定量收获、耗时短、效率高,高倍浓缩外泌体,整个处理过程静音、安全、顺畅,为外泌体的生产与研究提供了稳定、高效的工艺平台。

图1 CEL-G®TFF Lab系列外泌体浓缩系统
使用同腾新创CEL-G®TFF Lab系列外泌体浓缩系统从牙髓干细胞来源的细胞上清液中可提取出高质量的DPSC-EXO。
实验结果如下:
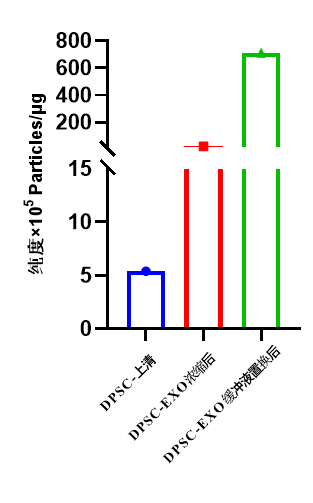
图2 DPSC-EXO浓缩前后纯度对比
牙髓干细胞外泌体终产物纯度明显提高(图2),浓缩前DPSC上清纯度5.4×105 Particles/μg,浓缩后DPSC-EXO纯度2.2×106 Particles/μg,缓冲液置换和除菌收获后DPSC-EXO纯度7.1×107 Particles/μg;结果表明通过CEL-G®TFF Lab系列外泌体浓缩系统得到的DPSC-EXO终产物比上清纯度显著提高。因此,CEL-G®TFFLab系列外泌体浓缩系统收获的DPSC-EXO终产物杂蛋白去除率高,达到了98.6%。
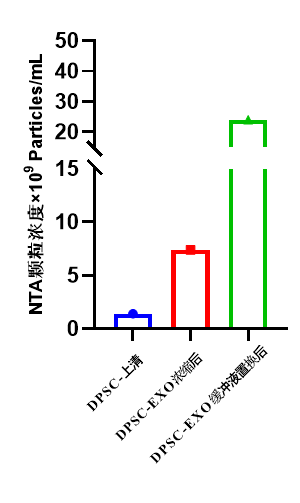
图3 DPSC-EXO浓缩前后NTA颗粒浓度对比
牙髓干细胞外泌体终产物浓度提高。浓缩前DPSC上清NTA颗粒浓度1.4×109 Particles/mL,浓缩后DPSC-EXO NTA颗粒浓度7.4×109 Particles/mL,缓冲液置换和除菌收获后DPSC-EXO NTA颗粒浓度2.4×1010 Particles/mL,结果表明通过CEL-G®TFF Lab系列外泌体浓缩系统得到的DPSC-EXO终产物比上清浓度显著提高(图3)。
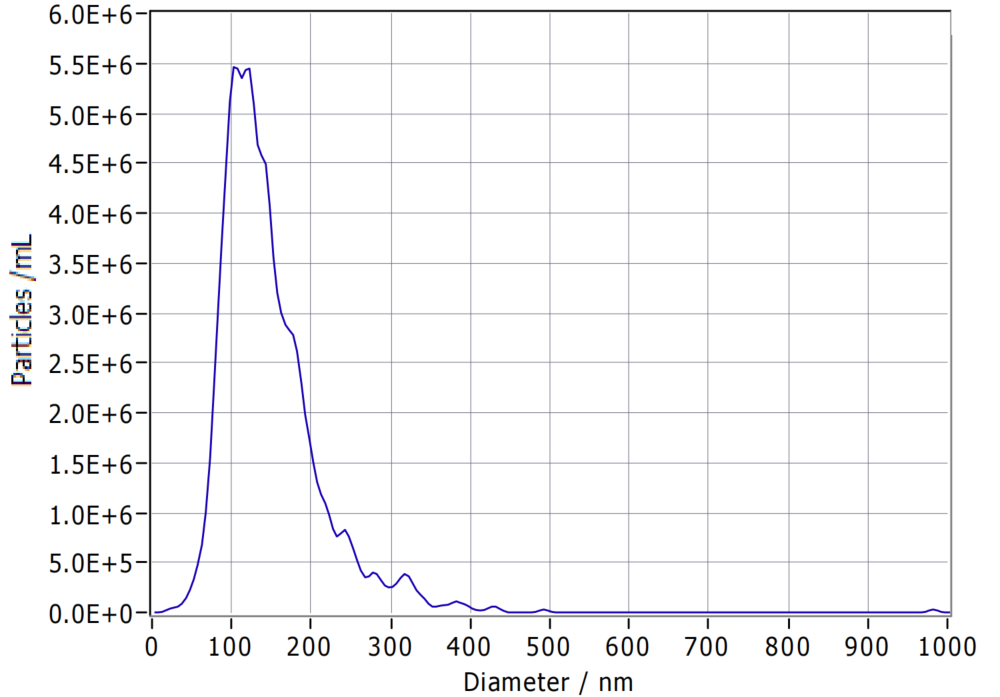
图4 DPSC-EXO终产物粒径分布图
通过CEL-G®TFF Lab系列外泌体浓缩系统处理后得到的DPSC-EXO终产物粒径114.5nm,符合外泌体30-150nm粒径尺寸要求(图4)。
同腾新创CEL-G®TFF Lab系列外泌体浓缩系统具有以下七个优点:
一.外泌体提取用时时间短。CEL-G®TFF Lab系列外泌体浓缩系统1小时可以完成10L上清原液的浓缩。
二.外泌体定量收获。CEL-G®TFF Lab系列外泌体浓缩系统可以进行10-50倍体积高效浓缩。
三.外泌体杂蛋白去除率高,终产物纯度高。通过CEL-G®TFF Lab系列外泌体浓缩系统浓缩的外泌体终产物相对原液上清纯度显著提高。
四.CEL-G®TFF Lab系列外泌体浓缩系统提取的外泌体浓度高,产量高,有助于实现外泌体规模化商品化生产!
五.外泌体浓缩自动化程度高。CEL-G®TFF Lab系列外泌体浓缩系统“浓缩、收获、置换、清洗”一键启动,更方便、更快捷、更高效!
六.外泌体形态功能完整性高。CEL-G®TFF Lab系列外泌体浓缩系统在一定程度上减少滤膜堵塞,更好的保证了外泌体形态功能完整性。
七.外泌体多重取样和留样方式。CEL-G®TFF Lab系列外泌体浓缩系统分别在中转袋和收获袋预留取样口和罗伯特管夹,解决了样本取样和分装的问题。
综上所述,同腾新创CEL-G®TFF Lab系列外泌体浓缩系统作为一种全新的牙髓干细胞外泌体提取方法,可以高效浓缩牙髓干细胞来源的外泌体,解决了传统提取外泌体方法上的不足,更省时,更高效。CEL-G®TFF Lab系列外泌体浓缩系统助力牙髓干细胞外泌体规模化生产,受到越来越多客户认可!未来我们将不断推出更多的产品和更好的技术,持续在不同细胞的外泌体领域,贡献更多的力量!
[1] Marote A, Teixeira FG, Mendes-Pinheiro B, et al. MSCs-derived exosomes: cell-secreted nanovesicles with regenerative potential[J]. Front Pharmacol, 2016, 7: 231
[2] Qiao X, Tang J, Dou L, Yang S, Sun Y, Mao H, Yang D. Dental Pulp Stem Cell-Derived Exosomes Regulate Anti-Inflammatory and Osteogenesis in Periodontal Ligament Stem Cells and Promote the Repair of Experimental Periodontitis in Rats. Int J Nanomedicine. 2023 Aug 17;18:4683-4703. doi: 10.2147/IJN.S420967. PMID: 37608819; PMCID: PMC10441659
[3] HE Hongzhi , MA Dandan. Research progress on exosomes derived from dental pulp stem cells[J]. Journal of Prevention and Treatment for Stomatological Diseases, 2019, 27(10): 652-657 https://doi.org/10.12016/j.issn.2096-1456.2019.09.008
[4] Mai Z, Chen H, Ye Y, Hu Z, Sun W, Cui L, Zhao X. Translational and Clinical Applications of Dental Stem Cell-Derived Exosomes. Front Genet. 2021 Oct 26;12:750990. doi: 10.3389/fgene.2021.750990. PMID: 34764982; PMCID: PMC8576041.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
