- News
案例应用丨固定床反应器在病毒载体大规模制备过程中应用
Release date:2024-09-27
病毒载体大规模制备需求及固定床反应器应用优势
细胞及基因治疗从研发到临床研究的快速发展,提高了对病毒载体大规模制备解决方案的需求。虽然悬浮细胞的应用越来越广泛,但许多病毒载体的制备仍然只适用于细胞贴壁培养体系,传统的基于二维培养瓶的贴壁培养体系虽然可以支持小批量的研究水平的病毒制备,甚至可以满足临床阶段早期的需求,然而II期及以后的临床试验,都需要大规模制备高滴度的病毒载体,仅使用培养瓶或10至40层细胞工厂从包装细胞系中生产病毒载体具有多重限制,其中包括且不限于收获时间限定较紧、人工劳动强度大、系统操作多为开放式并且需要大量的培养箱空间,这些限制为后续商业化规模的病毒制备带来了压力,为了克服当前工艺的局限性,固定床反应器这种扩展性高的三维贴壁培养体系正在逐渐应用流行。
固定床反应器填充有固定化细胞的固相载体材料,可以为细胞贴附生长提供适宜的介质类型、气体控制、温度控制及pH控制等多重精细化支持。当细胞被拦截在载体材料的空隙中时,培养液流经后与细胞进行传质传氧,这种培养方式极大的避免了搅拌引发的剪切力及碰撞造成的细胞损伤等。另外细胞在固定床反应器培养过程中的分布十分均匀,能对后续批次重复及放大提供稳定性与重复性支持,从而能加快产品上市速度。

图1:CEL-G® Culture Ad60系列固定床生物反应器及其载体膜材示意图
典型的病毒载体制造过程从复苏细胞起始,随后将细胞扩增到目标细胞数后并接种到固定床反应器中,在小规模条件下,细胞的初期扩增是十分讯速的,但将细胞扩增到满足固定床反应器所需的初始接种细胞量,也需要数周时间。在批次或灌流培养模式下,细胞量在反应器中进一步扩增。当细胞达到目标细胞密度时,通过感染(如腺病毒、流感病毒)、转染(如腺相关病毒、慢病毒、逆转录病毒)等过程诱导病毒载体的产生。病毒载体的产出通常需要几天时间。另外根据病毒类型的不同,病毒的收获途径包括直接从培养上清中收集出芽病毒或裂解细胞以收集裂解后的收获物来收获释放的病毒载体。
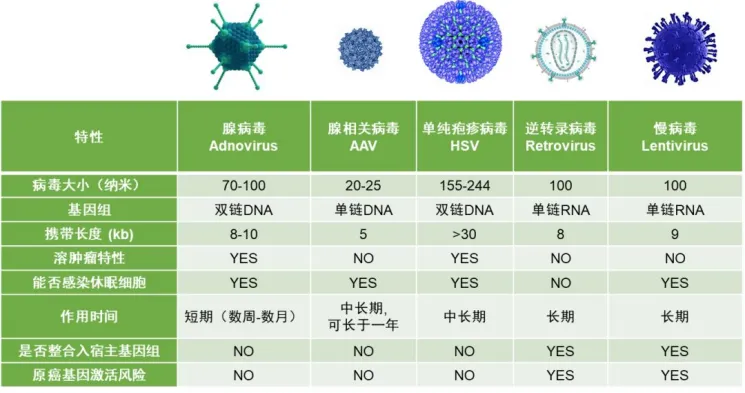
图二:主要病毒载体类型及其简易介绍
慢病毒载体是以HIV-1为基础发展起来的基因治疗载体,该载体可以将目的基因整合到分裂和非分裂细胞的基因组中,即能够将外源基因高效地整合到宿主的染色体上,从而达到外源基因的持久性表达。作为一种很有前途的基因治疗工具,目前的工艺瓶颈是如何扩大用于临床目的的高质量慢病毒载体的生产规模,固定床反应器在其制备应用中具有许多优势并有很多应用案例。
Valkama等研究人员通过在固定床生物反应器中通过瞬转293T细胞来生产慢病毒载体,通过筛选转染试剂及优化pH等培养工艺条件,发现了固定床反应器可以应用于从实验水平扩展到临床规模的慢病毒载体生产。Alexandra通过优化瞬转工艺,在固定床反应器中收获了106 TU/mL功能滴度的病毒,实现了慢病毒载体在固定床系统中的生产过程。Molmed通过对转染及收获条件的优化,在固定床反应器的放大规模运行中,在66 m2及133 m2的反应器中分别收获了4.4 × 1012 TU和1.1 × 1013 TU总量的病毒载体。另外在实际应用过程中,使用CEL-G® Culture Ad60系列固定床生物反应器对293T细胞瞬转进行慢病毒载体制备,收获的单位面积的病毒滴度在其他品牌固定床的2倍左右,有着更为优异的慢病毒载体制备表现。
逆转录病毒是一类RNA病毒,该病毒载体在特异性感染进入分裂期细胞后,通过逆转录及整合作用可将基因整合至宿主细胞染色体DNA上,从而将非病毒基因导入细胞体内,并可伴随细胞分裂将其传递给子代细胞。因其转染范围广,转染率高等优势,在基因治疗中也有着广泛应用。
Xiuyan Wang用固定床反应器制备表达嵌合抗原受体或T细胞受体的逆转录病毒载体,通过优化收获工艺,对于PG13和293包装细胞,在固定床反应器中收获的的病毒载体量分别比细胞工厂中获得的高3.2 ~ 7.3倍和5.6 ~ 13.1倍,PG13和293Vec单位细胞的载体生产效率分别是细胞工厂的10.4倍和18.6倍。此发现表明固定床反应器工艺可以用于生产商业化阶段的逆转录病毒载体。另外在实际应用过程中,使用CEL-G® Culture Ad60系列固定床生物反应器进行逆转录病毒载体制备,固定床可以极大的提高逆转录病毒的产量,单位面积平均病毒产量可以达到10层细胞工厂的2.6倍左右。
AAV是目前发现结构最简单的、无包膜的单链DNA病毒。其自身不能复制,必须依赖于腺病毒、疱疹病毒、杆状病毒等辅助病毒复制。AAV具有能长期表达、毒性低、免疫原性低、组织特异性高等优势,目前在生物学特别是神经生物学领域中被广泛使用,已成为基因治疗领域最重要的基因载体之一。
Hanna P利用固定床反应器优化了转染HEK293细胞制备血清5型AAV的工艺,在培养面积4 m2下,收获了6.1 x 1015 vp总产量的病毒颗粒。Alicia D优化了HEK293T/17细胞在固定床生物反应器中的瞬时转染工艺,通过优化转染时DNA的浓度、收获时间、PEI/DNA复合物的粒径大小等条件,将AAV产量提高到9.0×1014 vp/m2,同时发现在整个固定床内细胞转染率高达97%。这些数据证实了固定床反应器为大批量制备AAV病毒载体提供了有效的生产系统。另外在实际应用过程中,使用CEL-G® Culture Ad60系列固定床生物反应器进行AAV病毒载体制备,在培养面积2 m2、工艺直接转移培养瓶未经优化的状态下,一共收获了8.29 x 1014 vg总量的病毒,和某进口品牌的反应器相比,病毒产量高了3.5倍左右。
腺病毒是一种无包膜的双链DNA病毒,在体内以及体外,可转导多种哺乳动物的分裂期细胞和非分裂期细胞。作为基因治疗领域的先驱工具之一,复制缺陷的人类重组腺病毒V5(HadV5)作为模式系统已经广泛应用在真核基因表达分析、疫苗研究和基因治疗等领域。
Hanna P应用100 m2培养面积的固定床反应器制备腺病毒载体,收获了5.3 x 1015 vp总量的病毒,该制备方法的单位面积病毒产量与培养瓶相当。Piia Valonen等人应用固定床反应器制备Ad-GFP腺病毒载体观察到病毒滴度在8.53 × 1010 vp/ml ~1.11 × 1011 vp/ml之间,证明了固定床反应器可以用作一种实用的腺病毒生产替代方案。
流感病毒,Chiachun Lai应用固定床反应器制备H5N1以及H7N9流感病毒,分离得到的HA蛋白分别约为39.2和18.0 μg/ml,此结果证明了固定床反应器在流感病毒制备中的总体有效性,对更快地生产疫苗具有重要意义。另外在实际应用过程中,使用CEL-G® Culture Ad60系列固定床生物反应器用MDCK细胞进行甲型A3及BV型流感病毒制备,在培养面积2 m2及20 m2工艺下分别收获了5.8 L及9.5 L高产量的病毒液,证实了本款固定床在流感病毒制备领域优异的产出能力。
单纯疱疹病毒(HSV),在实际应用过程中,使用CEL-G® Culture Ad60系列固定床生物反应器在骨肉瘤细胞中制备HSV-1病毒,收获的病毒产量是同等规模细胞培养板的2.4倍,同时应用本固定床反应器实现了无需冻融裂解细胞直接在上清中收获病毒的简单工艺。
牛疱疹病毒(BHV),应用固定床反应器进行牛疱疹病毒制备的结果发现病毒产量与10层细胞工厂和10 L微载体生物反应器培养效果相当,证明该系统适用于牛疱疹病毒的生产。
安卡拉牛苗病毒(MVA), Havelange等人的研究表明,与静态系统相比固定床反应器中病毒产量能够提升20-60%。
Knowles等人广泛的研究了固定床反应器中不同细胞类型的病毒制备,通过使用CEF、MDBK、A540和Vero细胞来制造MVA、BHV、流感病毒或副粘病毒,结果证明即使保持细胞培养条件和工艺参数与培养瓶相同,将工艺扩大到固定床反应器所有的病毒产量都有着直接的提升。
在病毒载体制备过程中,较小规模的研发及工艺开发过程有着多种培养方式选择。但在生产及商业化规模阶段,固定床反应器的操作简便智能,培养面积扩展性强,其应用优势是巨大的。据目前的发展趋势,固定床反应器将以越来越快的速度用于涵盖病毒载体制备的多种生物相关产物产出过程。未来,越来越多的固定床生物反应器生产商将进入市场,共同推动着固定床反应器进一步的发展成熟。
1、Hanna P, Lesch,Piia, Valonen,Minna et al.Evaluation of the Single-Use Fixed-Bed Bioreactors in Scalable Virus Production.[J] .Biotechnol J, 2020, 16: 0.
2、A J, Valkama,H M, Leinonen,E M, Lipponen et al. Optimization of lentiviral vector production for scale-up in fixed-bed bioreactor.[J] .Gene Ther, 2018, 25: 0.
3、Alexandra, McCarron,Martin, Donnelley,Chantelle et al. Transient Lentiviral Vector Production Using a Packed-Bed Bioreactor System.[J] .Hum Gene Ther Methods, 2019, 30: 0.
4、Xiuyan, Wang,Malgorzata, Olszewska,Jinrong et al. Large-scale clinical-grade retroviral vector production in a fixed-bed bioreactor.[J] .J Immunother, 2015, 38: 0.
5、Hanna P, Lesch,Kati M, Heikkilä,Eevi M et al. Process Development of Adenoviral Vector Production in Fixed Bed Bioreactor: From Bench to Commercial Scale.[J] .Hum Gene Ther, 2015, 26: 0.
6、Alicia D, Powers,Bryan A, Piras,Robert K et al. Development and Optimization of AAV hFIX Particles by Transient Transfection in an iCELLis(®) Fixed-Bed Bioreactor.[J] .Hum Gene Ther Methods, 2016, 27: 0.
7、Leinonen, H., Lepola, S., Lipponen, E.M et al. Benchmarking of scale-X TM bioreactor system in lentivirus and adenovirus production. Hum Gene Ther. 31:376-384. doi:10.1089/hum.2019.247
8、Chia-Chun, Lai,Tsai-Chuan, Weng,Yu-Fen et al. Evaluation of novel disposable bioreactors on pandemic influenza virus production.[J] .PLoS One, 2019, 14: 0.
9、Knowles, S., Drugmand, J-C., Vertommen, N et al. Linear scalability of
virus production in the integrity® iCELLis® single-use fixed-bed bioreactors from
bench to industrial scale. BMC Proc. 7(S6):P60. doi:10.1186/1753-6561-7-s6-p60

- 021-50826962
- sales@ttbiotech.com
-
No. 90 Zhaoxi Road, Taicang City, Suzhou City, Jiangsu Province
