- News
案例应用丨固定床VS微载体外泌体制备,更高!更快!更优!
Release date:2024-06-24
外泌体,1983年之前一度被视为细胞代谢“垃圾”。1987年,Johnstone首次将小囊泡命名为“exosomes”外泌体。2013年,经过近30年的探索,外泌体在细胞间运输调控的机制被进一步深入挖掘,美国科学家James E. Rothman、Randy W. Schekman及德国科学家Thomas C. Südho因此共同获得2013年诺贝尔生理学或医学奖。

其中,Randy W. Schekman发现了囊泡运输涉及的一系列基因;James E. Rothman阐明了囊泡与目标细胞融合并转移囊泡内装载物的蛋白机制;Thomas C. Südho揭示了信号分子如何指导囊泡精准释放装载物的机制。
外泌体(Exosome,图1.外泌体产生机制及内容物简图)由细胞膜内陷形成内体(endosome),然后经过早期内体(Early endosome)、晚期内体(Late endosome)、多泡体(Multivesicular bodies,MVB)最后分泌到细胞外形成外泌体(exosomes)[1]。外泌体具有低免疫原性、免疫调控、组织损伤修复作用,使其在癌症诊断治疗、移植物抗宿主病(graft versus host disease ,GvHD)、器官损伤修复、心血管疾病研究、干细胞治疗、炎症及免疫疾病研究、药物递送、皮肤抗衰医美领域都有广泛应用[1]。外泌体自2013年获得诺贝尔生理学或医学奖以来,一直是CGT领域研究热点。外泌体可以代替来源细胞产生同样的调控效果,同时外泌体可跨越血脑屏障,大大拓宽了外泌体在阿尔茨海默病(Alzheimer’s disease,AD)、帕金森综合征(Parkinson’s disease, PD)、抑郁症(Depressive disorder)等神经损伤研究领域中的应用。但目前大规模制备外泌体仍是行业难点,也是外泌体加快应用研究的限制因素。为了解决外泌体大规模制备限制问题,科研工作者不断推出新的培养技术,从传统2D培养常用的T瓶、培养皿、细胞工厂,2D过度到3D常用的微载体、填充床、流化床,以及3D培养模式下的固定床生物反应器[4]。本文将探讨固定床生物反应器在外泌体大规模制备中相对于微载体的应用优势。
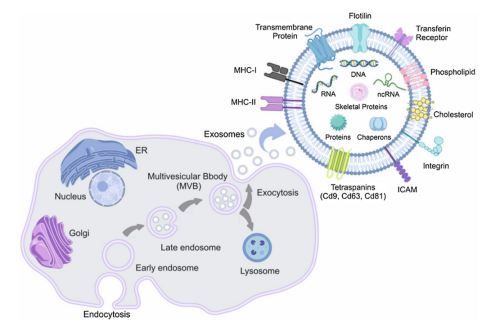
图1.外泌体产生机制及内容物简图[1]
相对于传统2D培养,微载体大大提高了培养基利用率及单位体积产物产量。但仍存在一些问题需要解决。固定床生物反应器结合载体与反应器,细胞远离搅拌桨避免了机械剪切力对细胞造成的损伤。
无论使用微载体还是固定床生物反应器制备外泌体,首先都需进行细胞扩增。使用微载体进行贴壁细胞培养(图2.使用微载体进行外泌体制备),需要进行微载体使用前处理:干燥微载体需先用DPBS或培养基进行充分溶胀、清洗、灭菌;细胞接种后需要进行低转速间歇启停使细胞贴附于微球上。如35rpm 运行5min,停止运行2h使细胞与微载体自然沉降接触,以便使细胞贴附微球,如此重复运行24h。实际使用过程中,细胞在沉降过程中会发生聚团不利于细胞全部贴附及均匀分布,上清中仍存在游离细胞[6](图3.不同微载体培养过程中游离细胞及细胞活率对比),同时重复启停程序产生的机械剪切力会对细胞造成损伤。微载体细胞分布不均现象普遍存在(图4.微载体上细胞分布)[2]。宏观上细胞悬浮培养,微观上细胞仍然是2D贴附扩增。
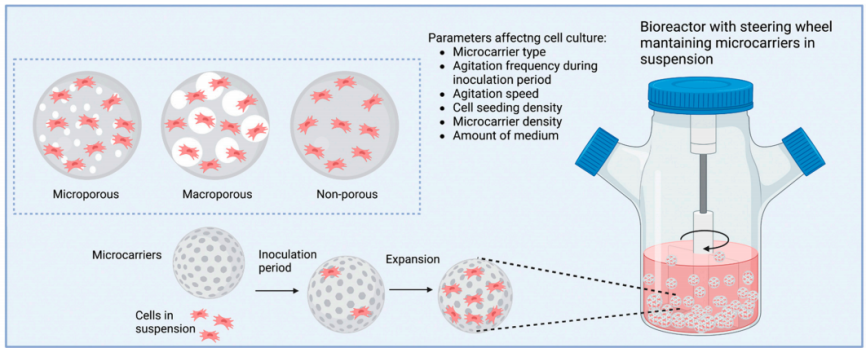
图2.使用微载体进行外泌体制备[3]
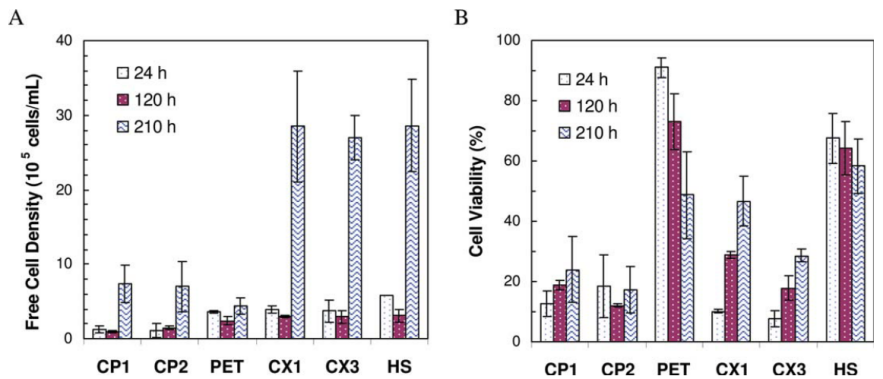
图3.不同微载体培养过程中游离细胞及细胞活率对比[6]
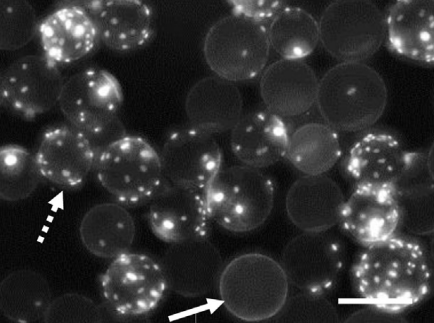
图4.微载体上细胞分布[2]
未充分贴附细胞处于游离状态在后续培养中因为机械剪切力而破碎为细胞碎片,增加细胞扩增环境中代谢废物浓度,同时载体微球上贴附细胞也会在搅拌培养过程中受到机械剪切力,限制细胞的扩增速度及增加培养上清中细胞碎片,给下游外泌体浓缩纯化增加了难度[3]。使用搅拌罐进行连续培养时,放大规模需要先使微载体自然沉降后,添加新的微载体,使细胞在新球与旧球之间扩增重复起初细胞扩增模式,机械剪切力是微载体培养细胞无法避免的问题[4]。
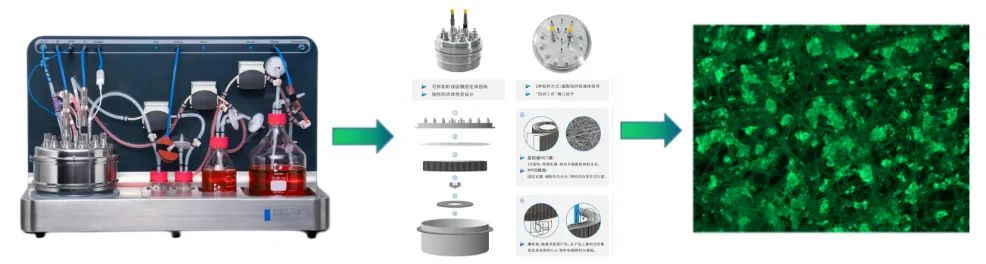
图5.使用固定床生物反应器进行外泌体制备
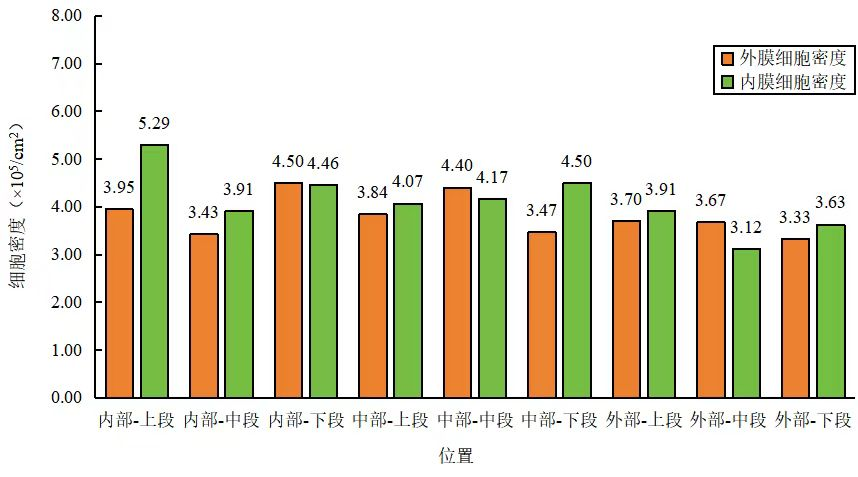
图6.细胞在膜包载体内不同位置细胞分布密度
相对于微载体悬浮培养模式,CEL-G® Culture Ad60固定床生物反应器(图5.使用固定床生物反应器进行外泌体制备)使用一次性膜包,膜包使用前处理只需要润洗灭菌,操作简单。CEL-G® Culture Ad60培养参数程序化,培养周期内自动化精准控制DO、PH、温度、流速,可一人同时控制多台固定床生物反应器;耗材灵活配制,满足不同工艺需求,管路耗材组装简单快速;细胞接种后,固定床膜包载体可以快速拦截接种细胞,4h即可达到98%的细胞拦截率,大大缩短细胞贴附时间从而保证细胞能快速贴附扩增,为提高外泌体产量提供支撑;细胞固定在膜包载体内,避免了机械剪切力对细胞的损伤,为细胞扩增提供更加温和适宜的生长环境;瀑布流为细胞扩增提供充分溶氧和新鲜培养基,避免气泡产生,保证了细胞在膜包内快速增殖;取样条贯穿整个膜包,取样具有代表性,细胞在膜包载体内不同位置分布均匀(图6.细胞在膜包载体内不同位置细胞分布密度);细胞拦截固定在膜包内,在进行连续培养时可满足同一批次接种细胞多次收获外泌体上清,大大缩短制备周期、提高产量、节省物料成本及时间成本[5][6],实现外泌体制备效率更快,产量更高,质量更优!
人脐带来源间充质干细胞(hUC-MSC)分别使用微载体(Microcarrierr)与CEL-G® Culture Ad60固定床生物反应器(Fixed Bed bioreactor)培养3批次,收获上清进行NTA检测上清原液颗粒浓度(图7.收获上清原液NTA检测结果对比),结果显示,使用固定床进行hUC-MSC外泌体制备,原液颗粒浓度相对于微载体实现了数量级的提高。
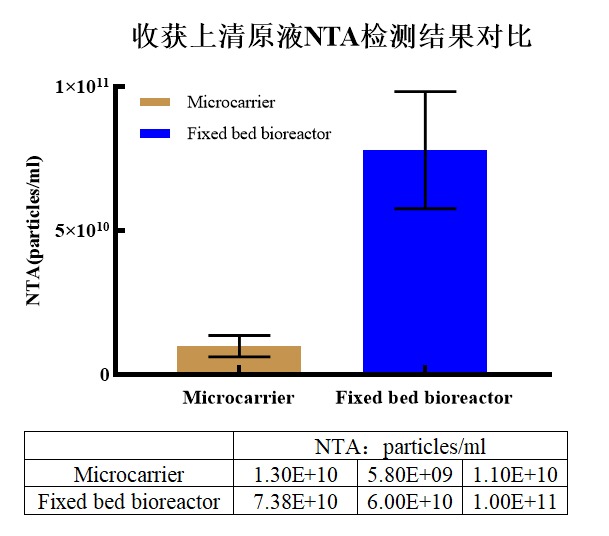
图7.收获上清原液NTA检测结果对比

表1.固定床与微载体应用对比总结
[1] Sadeghi, Somaye et al. “Exosome engineering in cell therapy and drug delivery.” Inflammopharmacology vol. 31,1 (2023): 145-169. doi:10.1007/s10787-022-01115-7;
[2] Cunha, Bárbara et al. “Bioprocess integration for human mesenchymal stem cells: From up to downstream processing scale-up to cell proteome characterization.” Journal of biotechnology vol. 248 (2017): 87-98. doi:10.1016/j.jbiotec.2017.01.014;
[3] Hassan, Muhammad Najib Fathi Bin et al. “Large-Scale Expansion of Human Mesenchymal Stem Cells.” Stem cells international vol. 2020 9529465. 15 Jul. 2020, doi:10.1155/2020/9529465
[4] Zhang, Yuanyuan et al. “GMP-grade microcarrier and automated closed industrial scale cell production platform for culture of MSCs.” Journal of tissue engineering and regenerative medicine vol. 16,10 (2022): 934-944. doi:10.1002/term.3341;
[5] Casajuana Ester, Mar, and Richard M Day. “Production and Utility of Extracellular Vesicles with 3D Culture Methods.” Pharmaceutics vol. 15,2 663. 16 Feb. 2023, doi:10.3390/pharmaceutics15020663;
[6] Wen, Yuan, and Shang-Tian Yang. “Microfibrous carriers for cell culture: a comparative study.” Biotechnology progress vol. 27,4 (2011): 1126-36. doi:10.1002/btpr.625
- 021-50826962
- sales@ttbiotech.com
-
No. 90 Zhaoxi Road, Taicang City, Suzhou City, Jiangsu Province
