- News
在CEL-G® Culture Ad60固定床生物反应器中进行细胞裂解条件研究
Release date:2024-10-28
细胞及基因治疗从研发到临床研究的快速发展,提高了对病毒载体大规模制备解决方案的需求。虽然悬浮细胞的应用越来越广泛,但许多病毒载体的制备仍然只适用于细胞贴壁培养体系。除此之外,贴壁培养还具有细胞生长速度快,产物表达量高,可以快速完成产品的研发和注册等优势。
和传统的2D贴壁培养相比,固定床生物反应器可以将2D平面培养转化为3D立体培养,在同样的空间中获得远超过2D培养的表面积。克服了培养瓶和细胞工厂培养细胞时收获时间限定较紧、人工劳动强度大、系统操作多为开放式并且需要大量的培养箱空间等缺点。同时,固定床生物反应器可以获得和悬浮反应器相同的在线监控能力,实时监测细胞培养环境中的温度、pH、DO等细胞培养参数。
同腾新创开发的CEL-G®Culture Ad60系列固定床生物反应器(Ad60 FBR),具有独特的瀑布流设计,让固定床具备更小的剪切力,提供更加亲和的细胞培养环境。能够提供从1㎡到100㎡培养面积,是培养贴壁细胞进行基因和病毒载体收获的理想平台。

图1. CEL-G®Culture Ad60系列固定床生物反应器
根据病毒形态结构的的不同,可以简单把病毒分为胞内病毒和胞外病毒,对于胞内病毒(如AAV,ADV),需要对细胞进行裂解,破碎细胞后使胞内病毒释放,然后进行收取。因此,在固定床反应器中培养贴壁细胞生产胞内病毒时,就需要在收获病毒时在反应罐内进行一步原位裂解细胞操作。
当前主流的裂解细胞的方式有2种,即热休克(反复冻融)法和裂解液裂解法。热休克法在使用培养瓶和细胞工厂生产病毒中较为常用,在反应器生产病毒中普遍使用裂解液裂解细胞。常用的细胞裂解液原理大多相似,但裂解过程中裂解液的组分、pH、裂解过程都会对最终病毒收获效率产生影响,裂解液的pH直接影响细胞的裂解效率,碱性环境更利于细胞裂解。同时,病毒载体的活性同样直接受到溶液环境中的pH影响。已知的可以维持病毒载体活性的pH范围在5.0-9.0左右,过高或过低均可能导致病毒载体的活性降低。在本实验中,我们在Ad60 FBR 2㎡固定床中培养293T细胞,在培养结束后尝试了pH7.0/8.0/9.0的裂解液来裂解细胞,寻找最适合病毒载体收获的细胞裂解条件。
配制裂解液:50mM Tris +2mMMgCl2+1%tween20+25U/ml核酸酶(1L)。
细胞上清和取样条取样,计数裂解前细胞密度,清空反应器内的培养基
向反应器中泵入900ml PBS缓冲液,700rpm冲洗固定床10min,排空PBS冲洗液;
向反应器中泵入900ml裂解液(不含核酸酶),700rpm冲洗固定床10min,排空裂解冲洗液;
向反应器中泵入900ml裂解液(加核酸酶,终浓度25U/ml),批次模式,37.0℃,pH 9.0/8.0/7.0,700rpm裂解2h。
排空裂解液,取样条取样,计数裂解后细胞密度,计算细胞裂解率。
裂解结束后,实验过程中不同步骤收获的3瓶液体区分明显,裂解后最终收获的裂解液颜色呈乳白色,结晶紫染细胞核计数,结果显示其中含有大量细胞和细胞碎片;对罐内取出的裂解前后取样条进行结晶紫染色对比,发现残留在膜上被染色的细胞极少;剪碎取样条计数,对比裂解前后膜上细胞量,数据显示最终裂解效率可达90%以上,证实在裂解液pH9.0时可以基本完全裂解细胞,达到释放胞内病毒的目的。

图2. pH9.0裂解前后上清对比

图3. pH9.0结晶紫染色裂解前后取样条
但同时,当裂解液的pH为7.0和8.0时,反应器中细胞裂解率则显著降低,仅有44.3%和68.3%,且和pH有线性相关:在pH7.0-9.0之间时,随着pH升高,裂解效率逐步升高。
表1. 不同pH实验组裂解前后总细胞数和细胞裂解率
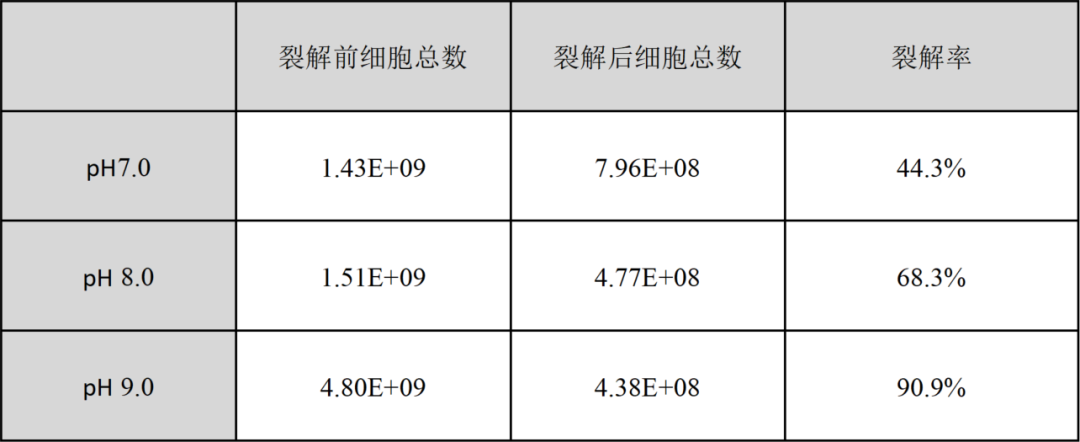
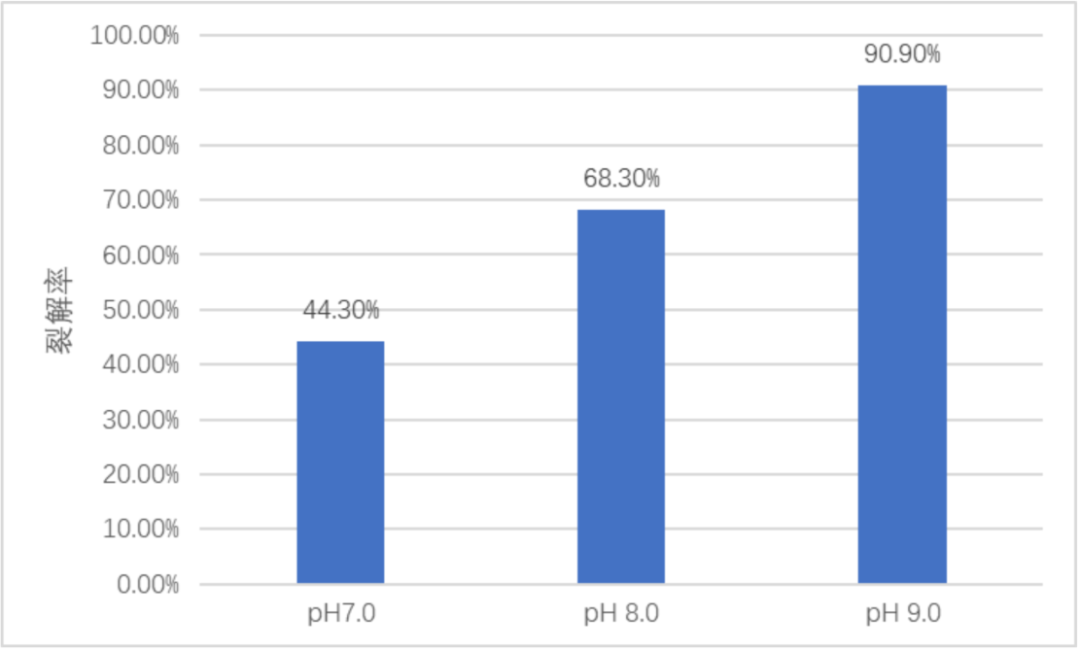
图4. 不同pH时贴壁细胞的裂解效率
通过3次在Ad60 FBR中使用不同pH裂解液裂解测试实验,得出结论,使用pH9.0的裂解液配方(50mM Tris +2mMMgCl2+1%tween20+25U/ml核酸酶 pH9.0)可以满足固定床培养细胞后收获病毒的需要,在pH降低到8.0和7.0时,裂解率随pH降低而降低。
综上,通过此次细胞裂解条件的研究,我们看到Ad60 FBR不仅可用于胞外病毒载体生产,在胞内病毒收获工艺中也有很大的应用潜力,并可方便的开展小试工艺研究,从而加速细胞及基因治疗药物从研发到临床的开发进程。
- 021-50826962
- sales@ttbiotech.com
-
No. 90 Zhaoxi Road, Taicang City, Suzhou City, Jiangsu Province
