-
新闻
案例应用丨革新流感疫苗生产,CEL-G® Culture Ad60系列固定床生物反应器助力降本增效
发布日期:2024-07-05
流感病毒是一种能引起急性呼吸道疾病的RNA病毒,具有高度传染性,可在人群中引起流行。根据世界卫生组织(WHO)报告,每年流感病毒造成全球10亿人感染,约29万至65万人死亡。季节性流感病毒每年在全球流行,导致200-500万例重症病例和多达25-50万人死亡[1]。因为抵抗病毒感染的免疫力减弱,婴儿和老年人的死亡率特别高。因此,每年流行的流感对人类健康和社会经济造成了极大的危害,从而成为全球公共卫生问题。接种疫苗是预防流感病毒感染及其严重并发症最有效的手段,但由于流感病毒容易发生突变,不同年份的毒株类型存在一定差异,每年流感疫苗生产企业会根据WHO预测的推荐流行毒株进行疫苗开发与生产。
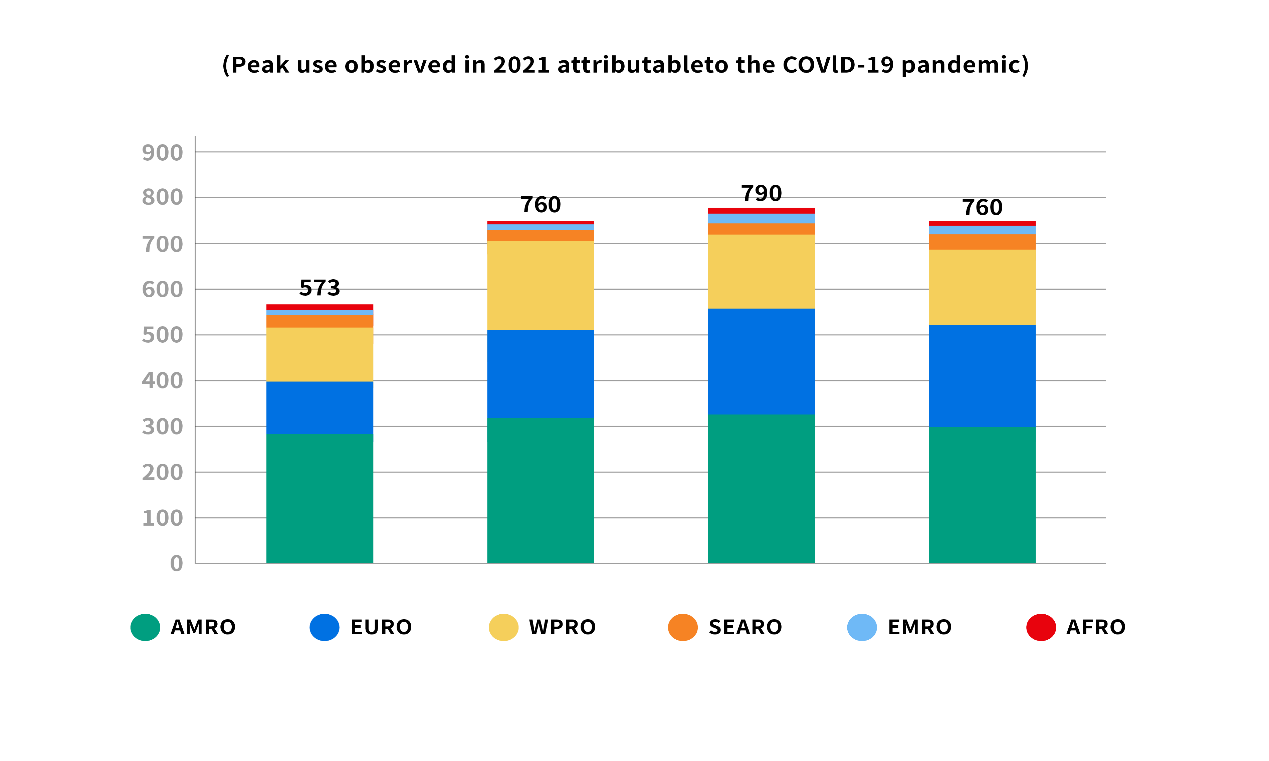
图1 WHO不同区域流感疫苗总量统计
从2019-2022年不同区域季节性流感疫苗总量统计来看,季节性流感疫苗的需求稳定,消费市场主要集中在中高收入国家,共消费了95%以上的流感疫苗。这表明季节性流感疫苗在不同收入群体中的使用不均衡,低收入国家流感疫苗消费市场有很大的增长空间,因此存在需求增长的机会。
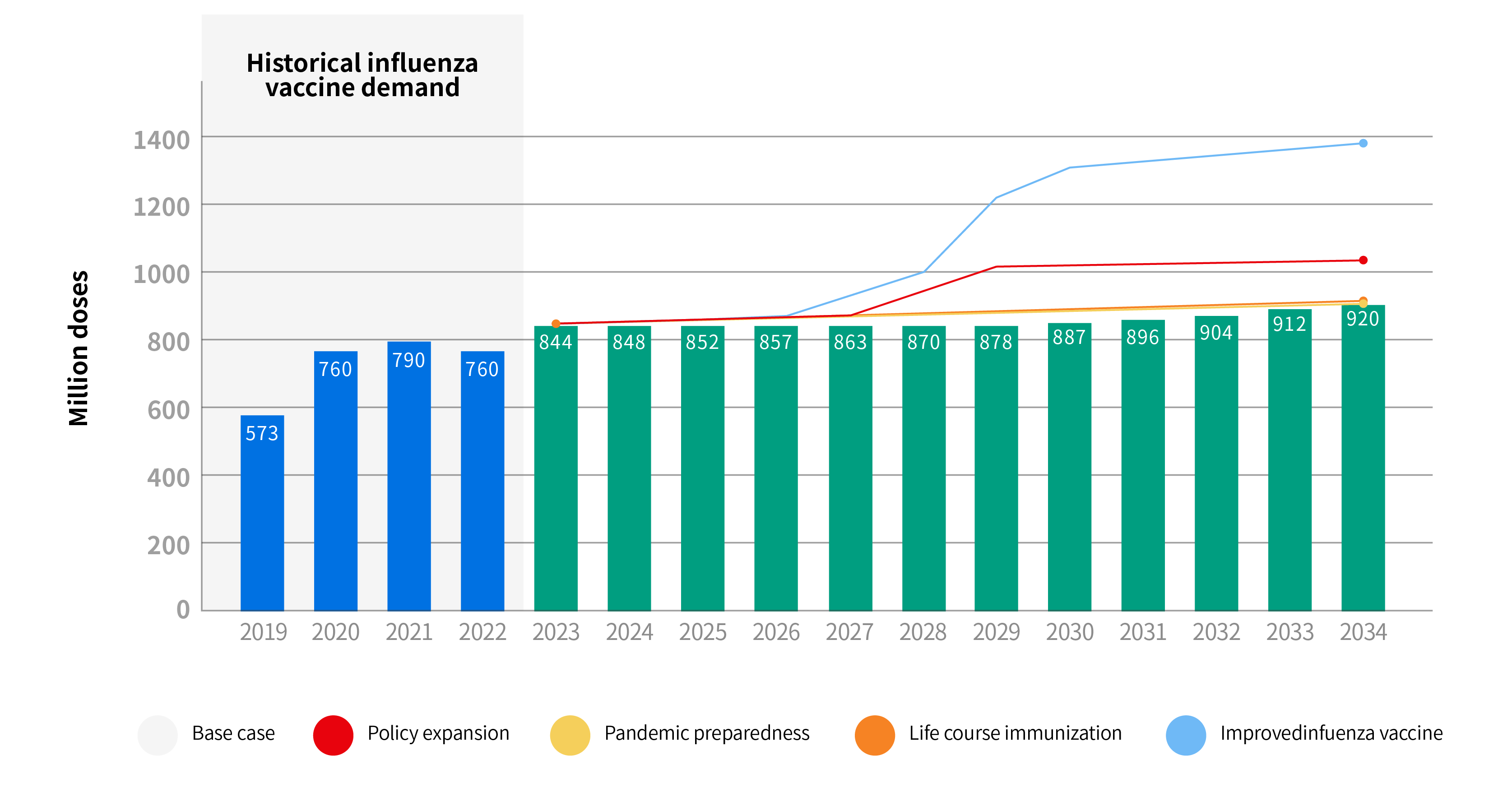
图2 全球流感疫苗需求预测
季节性流感疫苗的全球消费需求总体相对稳定,预计未来10年全球市场消费需求将增加约10%,随着中低收入国家拥有更多资金支持并辅以其他卫生干预措施下,季节性流感疫苗具有广阔的市场前景。
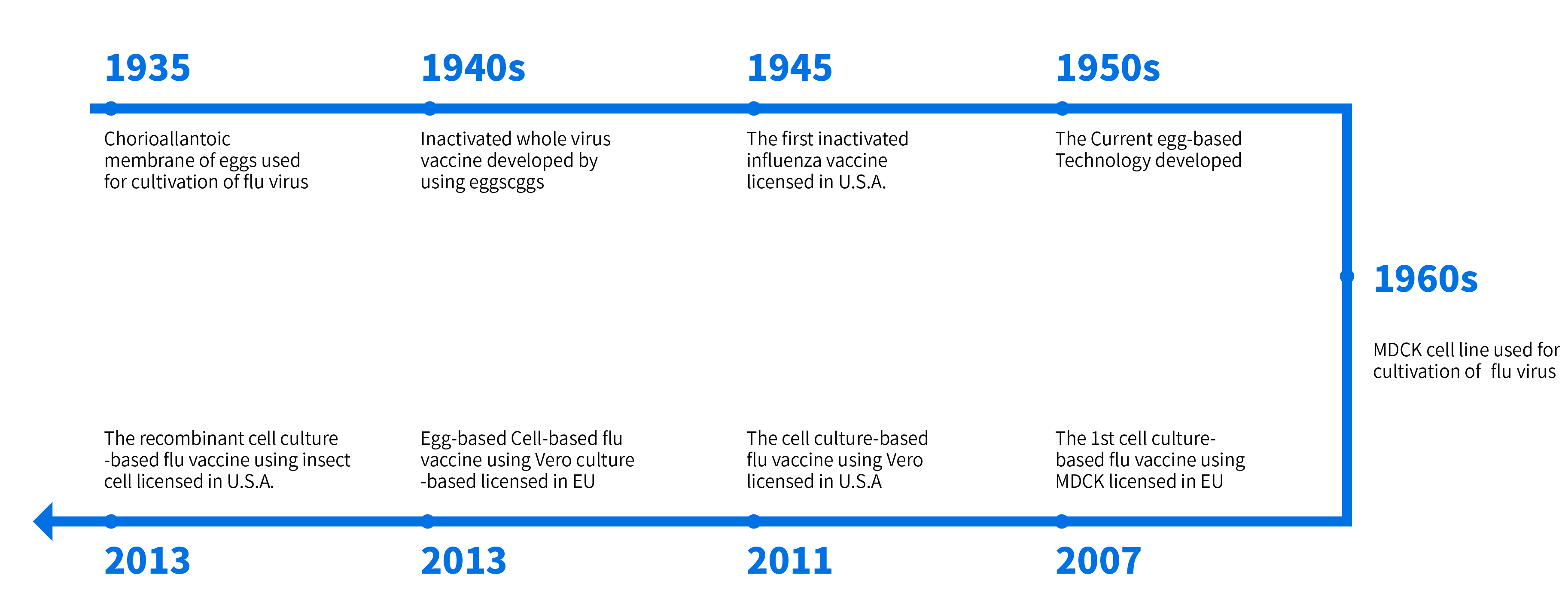
图3 流感疫苗生产基质从鸡胚到细胞的发展历史
细胞基质流感疫苗与传统鸡胚基质流感疫苗优势比较
表1. 细胞基质流感疫苗于鸡胚基质流感疫苗比较
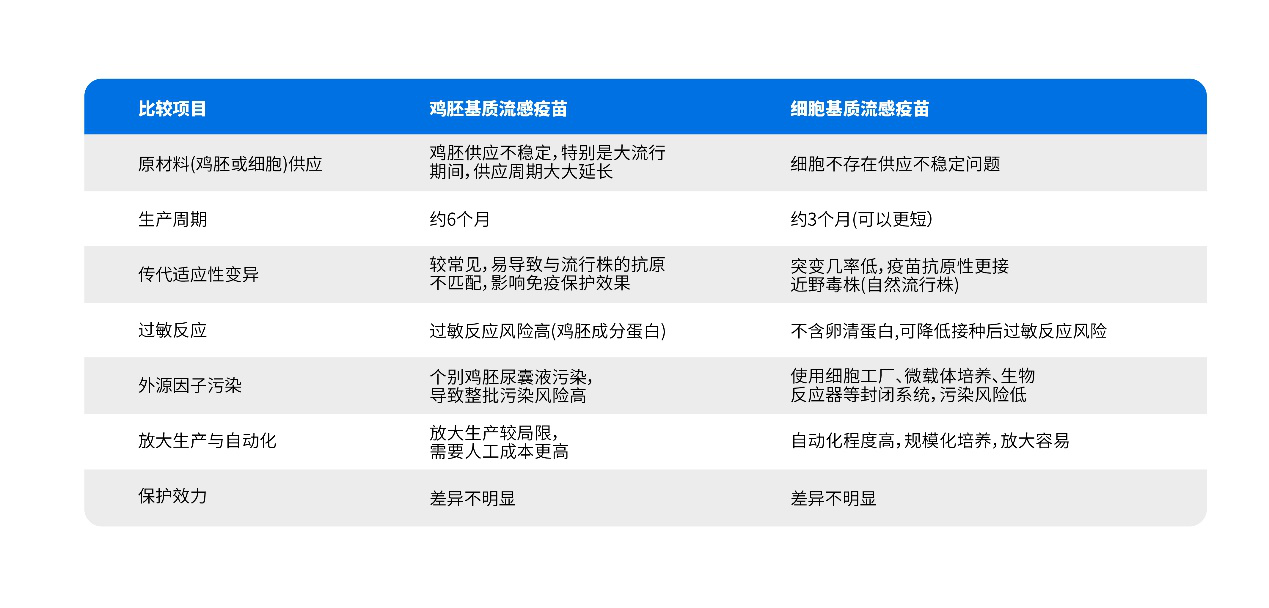
细胞基质流感疫苗与传统鸡胚基质流感疫苗比较,具有原材料供应稳定、生产周期短、突变几率低、过敏反应低、污染风险低、适应规模化放大生产的优势。
表2. 国际已上市的细胞基质的季节性流感疫苗
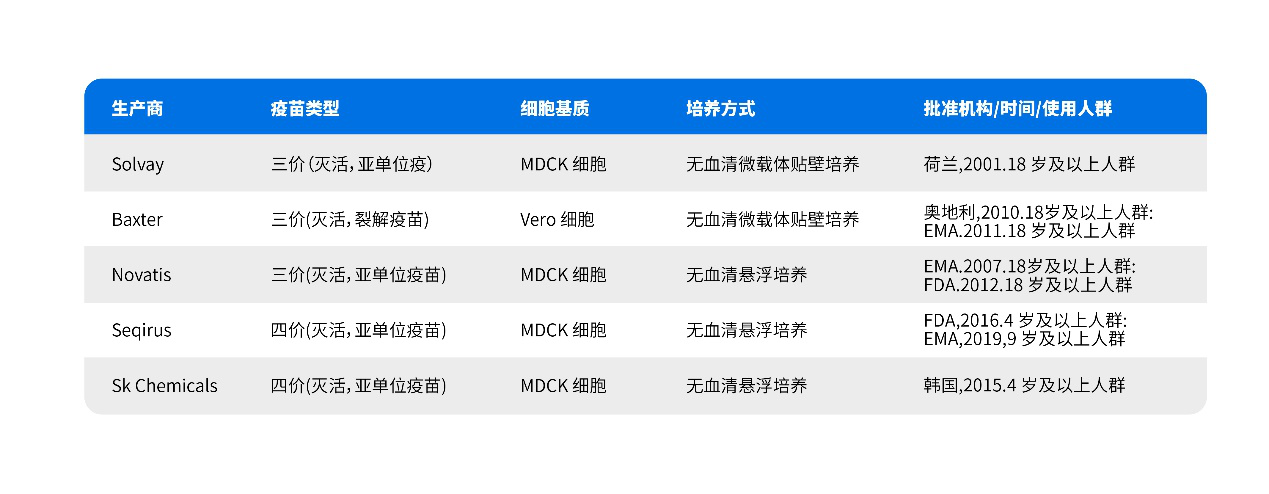
(注:EMA:欧洲药品管理局;FDA:美国食品药品监督管理局)
近年来国内外对新型流感疫苗的研究从未停滞,竞争激烈,疫苗价次越来越高,低成本高效疫苗在市场上更具优势,流感疫苗的“降本增效”有利于实现高接种率。其中,MDCK细胞系生产的流感疫苗效率更高、成本更低,受当前主流疫苗生产企业的青睐。
MDCK细胞是由Madin和Darby于1958年从犬肾脏组织分离培育建立的贴壁培养型细胞系, 相较于其他细胞系,MDCK细胞系具有增殖速度高的特点,流感病毒在MDCK细胞中复制更迅速,可以在3~10代内快速获得高产病毒株,从而有效缩短疫苗株生产时间,同时适应性代次的减少也可以降低疫苗株在传代过程中适应性突变发生的可能性[3]。因此,近年来MDCK细胞成为公认的最适合于流感疫苗生产的细胞系之一。此外,该细胞系较于适应无血清培养基,易于培养扩增,有利于大规模产业化生产。

同腾新创自主研发的CEL-G® Culture Ad60系列生物反应器,具有独特的瀑布流设计,让固定床具备更小的剪切力,提供更加亲和的细胞培养环境。针对目前流感疫苗行业常用的细胞系MDCK,CEL-G® Culture Ad60系列生物反应器通过对MDCK细胞高效扩增,在反应罐内将病毒种子接种到MDCK细胞中,经培养收获含有活病毒的细胞上清。
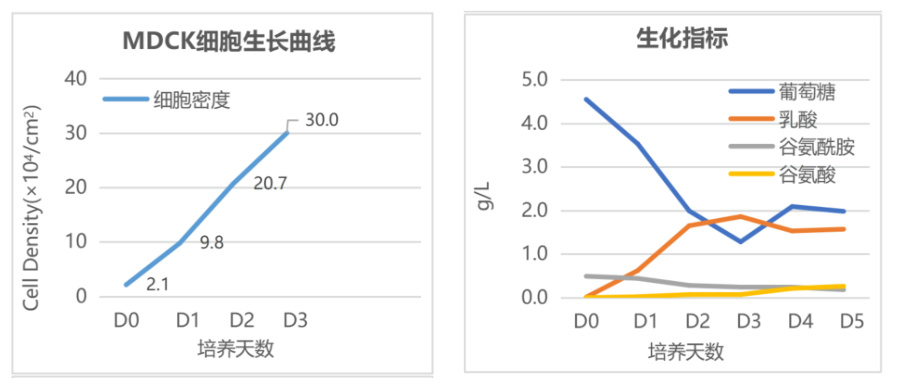
MDCK细胞生产乙型流感BV病毒工艺
固定床膜面积:4 m2 (定制)
细胞接种密度:2.1×104 cells/cm2
培养3天进行接毒
接毒时细胞密度:3.0×105 cells/cm2
48h后收获:5.8 L 病毒原液
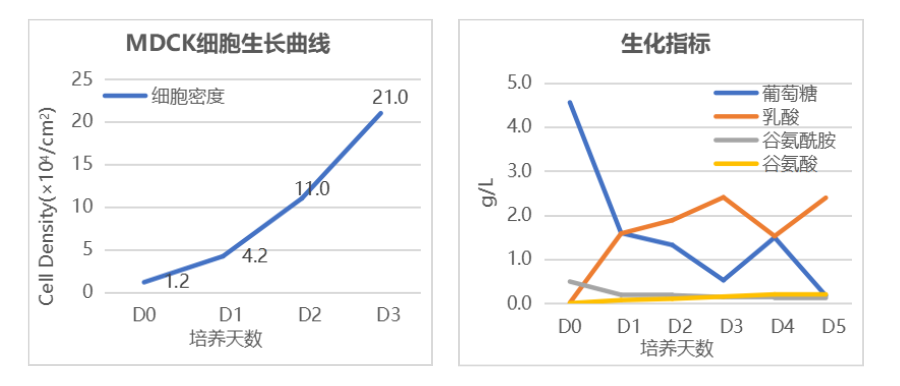
MDCK细胞生产甲型流感H3N2病毒工艺
固定床膜面积:20 m2
细胞接种密度:1.15×104 cells/cm2
培养3天进行接毒
接毒时细胞密度:2.1×105 cells/cm2
48h后收获:9.5 L 病毒原液
经实验证实,同腾新创开发的CEL-G® Culture Ad60系列生物反应器可用于MDCK细胞规模化培养和流感病毒生产,在生产过程中能轻松实现细胞生长状态追踪和生化指标监控,可有效保障工艺的稳健性,助力流感病毒疫苗的高效生产。
[1]Zhang J, Nian X, Liu B, Zhang Z, Zhao W, Han X, Ma Y, Jin D, Ma H, Zhang Q, Qiu R, Li F, Gong Z, Li X, Yang Y, Tian Y, Zhou L, Duan K, Li X, Ma Z, Yang X. Development of MDCK-based quadrivalent split seasonal influenza virus vaccine with high safety and immunoprotection: A preclinical study. Antiviral Res. 2023 Aug;216:105639. doi: 10.1016/j.antiviral.2023.105639. Epub 2023 Jun 1. PMID: 37270159.
[2]Liu S, Li J, Cheng Q, Duan K, Wang Z, Yan S, Tian S, Wang H, Wu S, Lei X, Yang Y, Ma N. A Single-Step Method for Harvesting Influenza Viral Particles from MDCK Cell Culture Supernatant with High Yield and Effective Impurity Removal. Viruses. 2024 May 13;16(5):768. doi: 10.3390/v16050768. PMID: 38793649; PMCID: PMC11125750.
[3] Kim EH, Kwon HI, Park SJ, Kim YI, Si YJ, Lee IW, Kim SM, Kim SI, Ahn DH, Choi YK. Generation of a High-Growth Influenza Vaccine Strain in MDCK Cells for Vaccine Preparedness. J Microbiol Biotechnol. 2018 Jun 28;28(6):997-1006. doi: 10.4014/jmb.1712.12007. PMID: 29642288.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
