-
新闻
在生物反应器中研究线速度对外泌体产量的影响
发布日期:2024-11-04
人体几乎所有细胞均可产生外泌体,且外泌体基于其内源性、生物相容性和多功能特性,可参与机体免疫调节、血管新生、细胞增殖及凋亡等环节,使其应用广泛。但目前大规模、低成本制备外泌体仍是行业难点[1],科研工作者及商业化公司在不断改进外泌体制备工艺,提高外泌体产量[1-2]。本文将介绍使用同腾新创(苏州)科技有限公司自主研发CEL-G® Culture Ad60系列固定床生物反应器(Ad60 FBR)通过提高培养基线速度提高外泌体产量的培养工艺。
文献中[3]提到使用3D打印灌流生物反应器培养骨髓来源间充质干细胞(Bone marrow-derived mesenchymal stem cells,BM-MSCs),通过提高灌流培养模式灌流速度增加切向力的方式提高细胞外囊泡(Extracellular vesicles ,EVs)产量,通常细胞外囊泡特指外泌体(Exosomes)。并对不同灌流速度下外泌体产量做了检测对比,从而确定产量最高的灌流速度(图1. BM-MSCs在灌流反应器5ml/min灌流流速下取得最高外泌体产量),在5ml/min流速下显著提高外泌体产量且未将反应器内细胞冲洗下来。
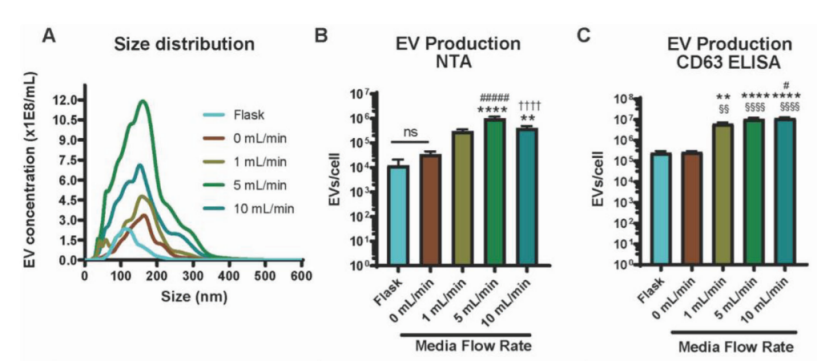
图1. BM-MSCs在灌流反应器5ml/min灌流流速下取得最高外泌体产量
有趣的是,HEK293细胞内发现同样的趋势。在相同的培养条件下,随着流速提高外泌体产量明显提高,单个外泌体蛋白含量降低(图2. HEK293使用灌流反应器EV产量提高)。
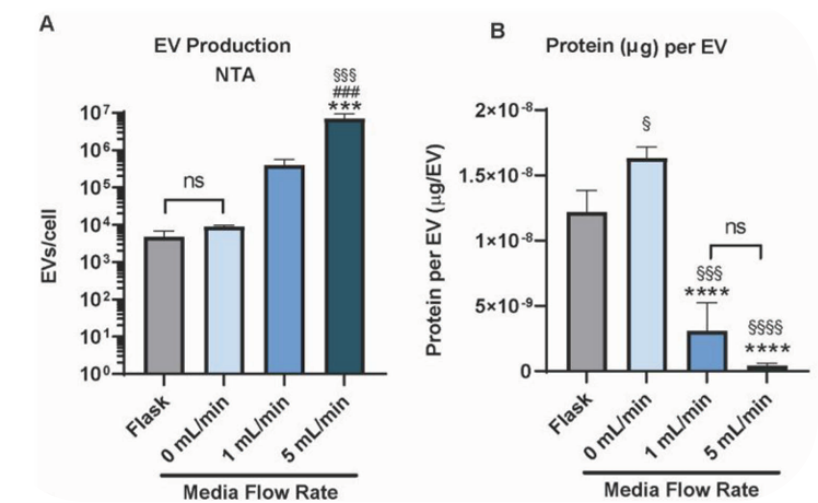
图2. HEK293使用灌流反应器EV产量提高
CEL-G® Culture Ad60反应器(Ad60 FBR)
上线速度对外泌体产量影响的研究
1) 概念验证
使用Ad60 FBR,2平米膜包和罐体,HEK293T使用相同培养基、相同细胞接种密度(2.4E4 cells/cm2),分别转速设置为300rpm提供0.5cm/s线速度,500rpm提供2cm/s线速度,批次模式培养进行概念验证。纳米颗粒分析(NTA)检测结果显示,线速度从0.5cm/s提高至2cm/s,外泌体产量增加2-4倍(图3. 批次模式不同线速度培养上清NTA检测结果)。
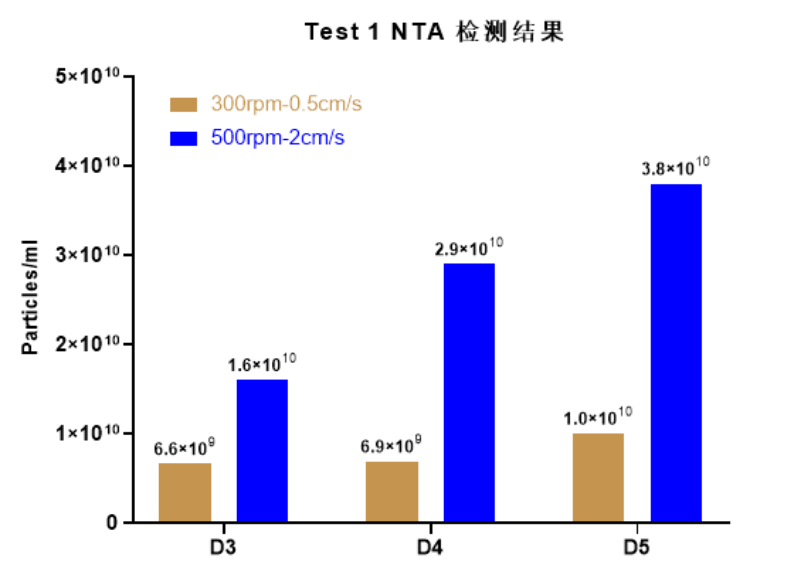
图3. 不同线速度培养上清NTA检测结果
2) 确认实验
使用Ad60 FBR,1平米膜包和2平米罐体,HEK293T使用相同培养基、相同细胞接种密度(0.5E4/cm2),分别转速设置为350rpm提供0.5cm/s线速度,550rpm转速提供2cm/s线速度,循环模式培养5天第一次收获上清,后续每隔48h收获一次上清,验证提高线速度可以增加外泌体产量(图4. 循环模式不同线速度培养上清NTA检测结果)。上清NTA检测结果显示:外泌体产量提高2-10倍,随着培养时间延长,外泌体产量提高趋势更加明显。
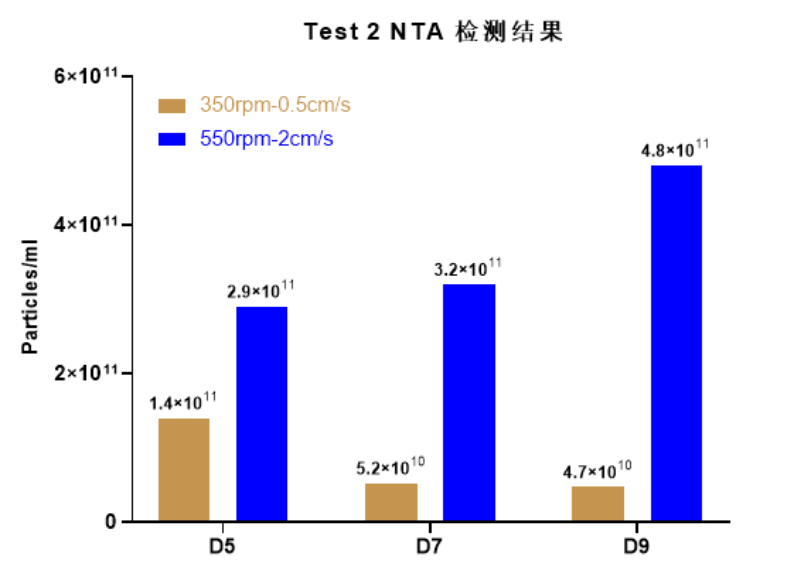
图4. 循环模式不同线速度培养上清NTA检测结果
结合文献灌流培养模式实验数据及同腾新创CEL-G® Culture Ad60固定床生物反应器(Ad60 FBR)两次测试数据(图3、图4),提高培养时罐内培养基线速度可显著提高细胞外泌体产量,此结果对大规模细胞培养提高外泌体产量有借鉴意义。
[1] Jakl, Viktoria et al. “A novel approach for large-scale manufacturing of small extracellular vesicles from bone marrow-derived mesenchymal stromal cells using a hollow fiber bioreactor.” Frontiers in bioengineering and biotechnology vol. 11 1107055. 24 Jan. 2023, doi:10.3389/fbioe.2023.1107055
[2] Kink, John A et al. “Large-scale bioreactor production of extracellular vesicles from mesenchymal stromal cells for treatment of acute radiation syndrome.” Stem cell research & therapy vol. 15,1 72. 13 Mar. 2024, doi:10.1186/s13287-024-03688-2
[3] Kronstadt, Stephanie M et al. “Mesenchymal Stem Cell Culture within Perfusion Bioreactors Incorporating 3D-Printed Scaffolds Enables Improved Extracellular Vesicle Yield with Preserved Bioactivity.” Advanced healthcare materials vol. 12,20 (2023): e2300584. doi:10.1002/adhm.202300584
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
